
新京报讯(记者 张秀兰)11月10日,国家药监局药品审评中心(以下简称药审中心)发布《中国新药注册临床试验现状年度报告(2020年)》(以下简称《报告》),这是药审中心首次对中国新药注册临床试验现状进行全面汇总分析。《报告》显示,2020年,药物临床试验登记与信息公示平台登记临床试验中,国内申办者占比超过70%,适应症主要集中在抗肿瘤和抗感染等领域。
《报告》显示,2020年,药物临床试验登记与信息公示平台登记的临床试验共2602项,较2019年总体增长9.1%,国内申办者占比超过70%。在药物品种方面,总体仍以化学药临床试验为主,占比达到73.6%,其次为生物制品,为23.8%,中药最少,仅为2.6%,其中新疗法在生物制品中的占比达到4.3%;化药、治疗用生物制品、预防用生物制品和中药的注册分类中占比最高的均为1类,分别为71%、65.4%、46%和61%;靶点同质化较为明显,主要为PD-1、VEGFR、PD-L1等,细胞治疗仍以CD19靶点为主。
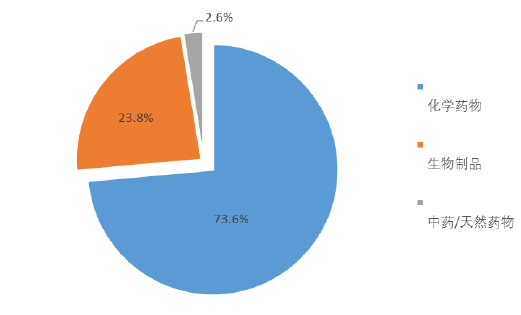
2020年,药物临床试验登记品种以化学药临床试验为主。图/中国新药注册临床试验现状年度报告
具体到适应症,抗肿瘤和抗感染等领域较为集中;受试者人群中,特定人群开展的临床试验相对较少,2020年在老年人群和儿童人群开展的临床试验分别为3项和33项,仅占全年试验登记总量的1.4%。化学药临床试验前10位品种基本为抗肿瘤药物,其中甲磺酸阿帕替尼片开展试验最多,为15项。生物制品开展临床试验的前10位品种主要为治疗用生物制品,其中重组人源化抗PD-1单克隆抗体注射液开展试验数量最多,为17项。
《报告》同时指出,中国新药临床试验的数量和药物品种的数量相较以往都大幅增加,同时1类新药占比较高,但药物靶点和适应症领域分布较为集中,显示我国药物临床试验迅速发展的同时,存在临床试验同质化的问题。临床试验效率等分析结果显示,我国临床试验存在获批后的实施效率不高、儿科药物临床试验占比较低、临床试验地域分布不均匀等挑战。
校对 卢茜









